生命科学与技术学院李维达团队关于糖尿病治疗新靶点的成果发表于《先进科学》
来源:生命科学与技术学院
时间:2025-04-11 浏览:
现有糖尿病药物每年约有5%-10%的继发性失效率,凸显了临床治疗中的困境。而当前药物研发体系面临“双重瓶颈”:一方面,传统药物筛选平台缺乏人类组织的药物筛选模型,动物模型的种属差异导致候选药物临床转化率偏低;另一方面,关键功能细胞的保护性靶点及作用机制尚未完全阐明。这种双重限制既制约了糖尿病治疗的长期效果,也阻碍了新型保护性药物的开发。因此,亟需系统解析胰岛β细胞等关键功能细胞的保护性靶点与机制,筛选并验证新型候选药物,防止功能细胞的失活与缺损,实现血糖的长期稳定控制,推动糖尿病治疗策略的革新。
为应对这一挑战,同济大学生命科学与技术学院李维达团队联合南京大学王高伟团队及海军军医大学郭猛团队在《先进科学》(Advanced Science)上发表了题为“A Compound Screen Based on Isogenic hESC-Derived β Cell Reveals an Inhibitor Targeting ZnT8-Mediated Zinc Transportation to Protect Pancreatic β Cell from Stress-Induced Cell Death”的研究论文。该研究基于“新靶点—新技术—新药物”的理念,实现了“AI助力靶点发现-类器官模型下高通量筛选-体内外多维度药效验证”糖尿病药物开发链条的先行验证。

该研究通过人胰岛细胞图谱与AI机器学习技术,系统揭示了ZnT8在不同糖尿病病程中的动态变化及其在胰岛β细胞缺损中的关键作用。通过干细胞体外诱导分化再生胰岛类器官,构建了与人类胰岛高度相似的类器官模型,并基于此平台引入糖尿病相关的遗传与环境致病因素,围绕保护性靶点ZnT8开展药物筛选。最终筛选并验证了首个ZnT8化学抑制剂——低剂量茴香霉素(25 nM)。动物实验进一步证实,该化合物可显著提高胰岛β细胞存活率,延缓高脂饮食诱导的2型糖尿病进程,成为突破现有药物继发性失效的潜在候选药物。分子对接还揭示了ZnT8与茴香霉素结合的关键残基,为靶向ZnT8的精准药物设计提供了分子基础。
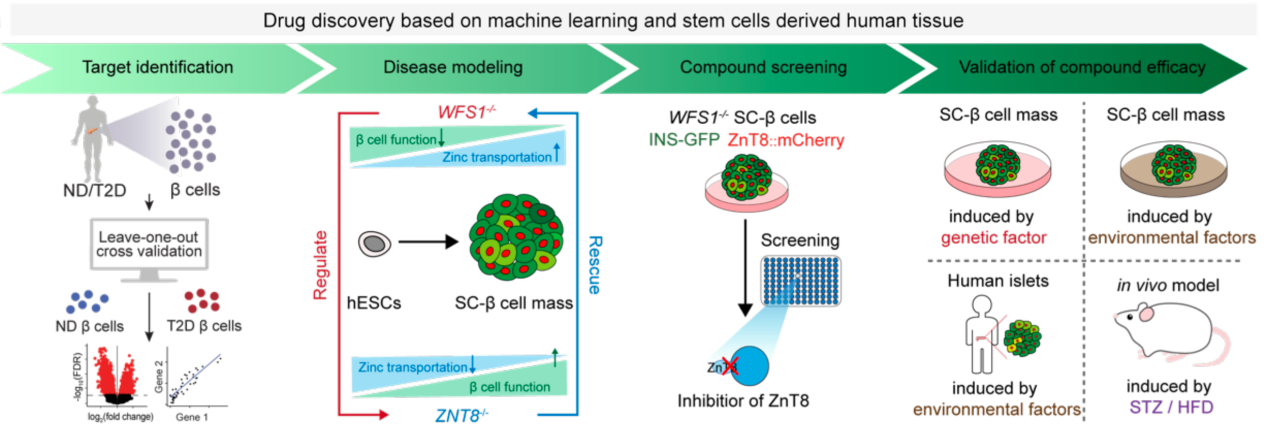
图1.“AI助力靶点发现-类器官模型下高通量筛选-体内外多维度药效验证”糖尿病药物开发链条
该研究创新性地融合类器官与AI技术,通过再生胰岛类器官平台模拟人类胰岛β细胞糖尿病病理微环境,突破传统模型的物种差异限制,揭示ZnT8是糖尿病中重要保护性靶点,并开发出兼具“细胞保护+功能促进”双重作用的新型化合物。这一发现不仅为糖尿病治疗提供了新的策略选择,更验证了“类器官+AI”平台在精准医疗中的广泛应用潜力,未来有望拓展至神经退行性疾病等复杂疾病的靶向治疗。目前,研究团队已启动下一阶段药物优化与临床转化研究,致力于推动全球首个靶向ZnT8的糖尿病药物进入临床,为“类器官+AI”驱动的精准医学树立新标杆。
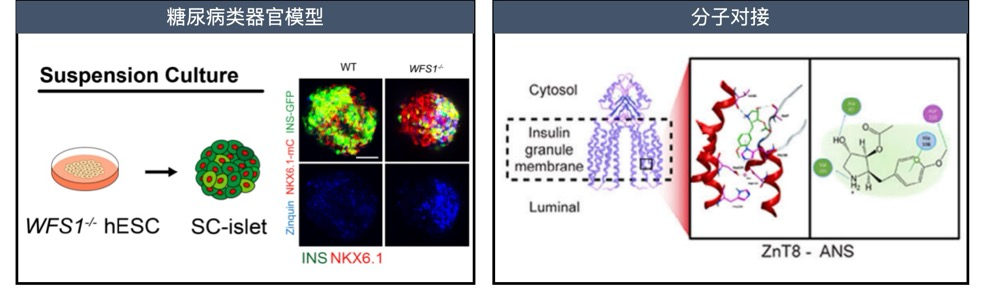
图2. 类器官模型下高通量筛选
同济大学李维达教授、南京大学王高伟教授、海军军医大学郭猛教授为论文共同通讯作者,同济大学胡瑞博士后、马青博士后、孔云辉博士研究生为论文共同第一作者。
论文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202413161